פרק 5 - שיטות וגישות במחקר
מקור לסיכומים מספר הקורס, אתר הקורס, והמנחה ד"ר גלית לנדסהוט!!
מאיפה מתחילים?
- לרוב יוצאים משאלה גדולה -
- מה השתבש בגוף?
- איך משפיעות תרופות?
- למה הרס נוירונים מסוימים מוביל לסימפטומים מסוימים?
- מה המנגנונים שעומדים בבסיס התנהגות מסוימת?
- לא ניתן לחקור בצורה מסוימת שאלה כללית כי היא רחבה מידי
- בתהליך המחקרי יש למקד את השאלה, ספציפית מאוד
- נדרש שיתוף פעולה מצד חוקרים על מנת לחבר את כל השאלות הספציפיות יחד
תאוריה
- מהן התאוריות הקיימות לשאלה אותה חוקרים
השערה
- תנוסח בצורה של קביעה
- נובעת מהתאוריה
- בניסוי נאושש או נפריך את ההשערה
- הפרכה ואישוש שניהם תורמים לתאוריה הכללית
משתנה תיאורטי
- אינו בר מדידה באופן ישיר
- הגדרת משתנים -
- להגדיר בצורה מדויקת
- לוודא שאפשר לבצע מניפולציה
- לוודא שאפשר למדוד אותו
הגדרה אופרציונלית
נגדיר איך נמדוד את המשתנה התיאורטי
תוקף ומהימנות
- לוודא שכלי המדידה יחזיר תוצאה זהה בחזרה על הניסוי
- לוודא שהכלי אכן מודד את המשתנה התיאורטי
אתיקה
- יש חשיבות רבה לניסויים בבעלי חיים
- התנהגויות, מבנה מוחי, מאזן כימי מאוד דומה לבני אדם
- נשאלת השאלה אם יש לחוקר לגיטימציה וזכות לעבוד עם יצורים חיים? לכפות עליהם מחקר.
2 גישות עיקריות
- טוענת שהמחקר אינו מצדיק כלל ניסוי בבעל חיים
- טוענת שבעלי חיים שגודלו במעבדה לצורך זה שייכים לה ולכן יש זכות לחוקר לבצע זאת
- רוב הדעות במרכז - מצד אחד אין לנו ברירה אלא לעבוד עם בעלי חיים על מנת לשפר רווחת כלל היצורים החיים, אך עלנו לעשות את המקסימום למזעור הסבל שלהם.
רישיון
על מנת לקבל זכות לעבוד עם בעלי חיים על כל אנשים הצוות במחקר לעבור קורס להסמכה לכך ועבודה הומנית ביותר
ועדת אתיקה
- בכל מוסד שמבצע מחקרים הכוללים בעלי חיים
- קיימת ועודה מוסמכת על פי החוק צער בעלי חים.
- מורכבת 50% ויותר לא מהתחום הנחקר
על מנת לקבל אישור על המחקר לעמוד ב-4 קריטריונים:
- Replacement - אין חלופה אחרת לשימוש בבעלי חיים.
- Reduction - צמצום למינימום את כמות החיות הסובלות.
- Refinement - היחס ההומני שהחיות צריכות לקבל בכלל גידולן, מפורט בצורה מדויקת בחוק.
- Responsibility - אחריות על כלל התנאים, ההכשרה, ווידוא שכל המחקר מתבצע על פי החוק בצורה ההומנית ביותר, היא על החוקר הראשי.
מחקר התנהגות
חקר למידה
Morris water maze
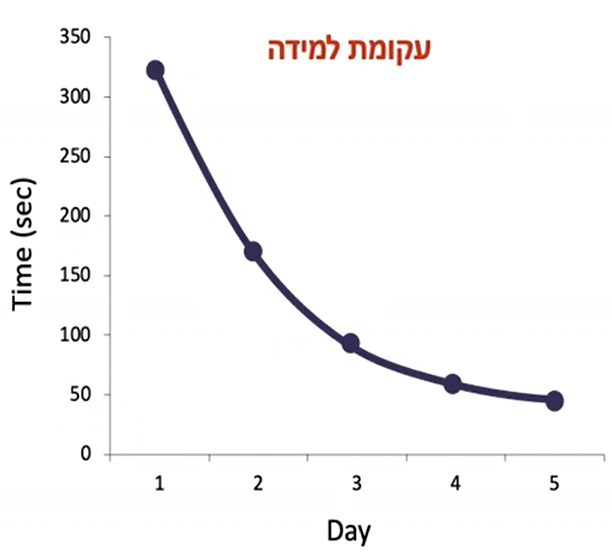
- חייב להיות רק על אורגניזם שלם - כל בעל חיים
- חשוב לבצע במגוון של כלים למדידה כגון מבוך רגיל, מבוך השחייה של מוריס, וכד'. על מנת לוודא שהמסקנה תקפה גם לסביבות ומרחבים שונים.
Morris water maze
- במבחן קערה עגולה גדולה מלאה במים
- משתמשים בעכברים/חולדות - שוחים מעולה, מתעייפים כמונו אחרי זמן ממושך
- כשמוצאים פלטפורמה חבויה במים נעצרים עליה ונעמדים
- מהלך הניסוי:
- ביום ה-1: ישחה באופן רנדומלי עד שיגיע לפלטפורמה
- יום 2: מכניסים שוב לבריכה ומודדים כמה זמן ייקח להגיע לפלטפורמה
- כך עושים מספרי ימים
- נוכל לבצע מניפולציה לאחר מכן על הפרט ולהסיק מסקנות על ההשערה שלנו

מחקר נוירואנטומי
מה שואלים?
כריתה ניסויית
ניתוח סראוטפתי
ניתוח שמכוון את החוקר במרחב המוחי
אטלס סראוטקטי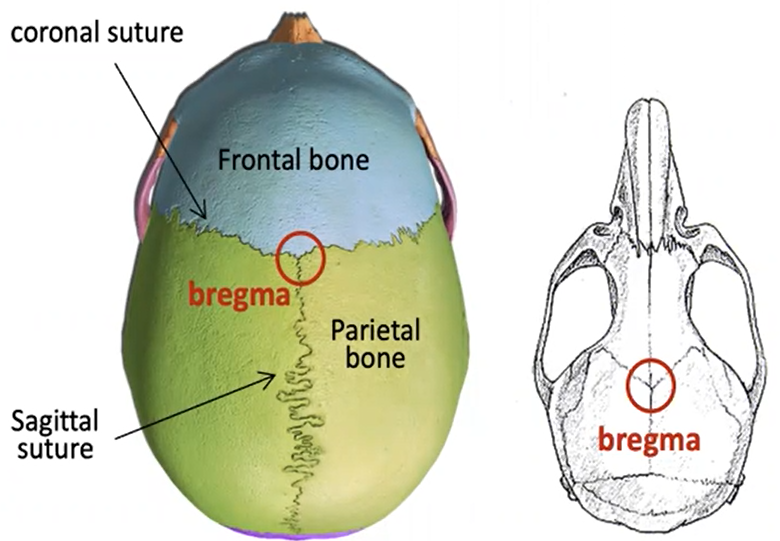
שיטות היסטולוגיות
- באילו תפקודים מעורב אזור מסוים?
- כיצד נראה המוח?
- התחקות אחר קשרים עצבים
כריתה ניסויית
- אם האזור נגיש ניתן לחתוך, להסיר חלק מהגולגולת ולהוציא את האזור מהקורטקס
- החיסרון - לא ניתן להגיע לאזורים עמוקים יותר
ניתוח סראוטפתי
ניתוח שמכוון את החוקר במרחב המוחי
אטלס סראוטקטי
- משמש לקביעת מקום הפגע
- ספציפית לכל אורגניזם
- בעל קנה מידה ושנתות - על מנת לדעת בכל ציר את המיקום המדויק
- נקודת הייחוס
- בה נפגשים כל חלקי הגולגולת
- לאחר זיהוי הברגמה
- נקבע את בעל החיים המורדם במכשיר סטראוטקטי
- בעל זרוע אחת שנכנסת לעומק המוח ב-3 הצירים
- אצל בני אדם מבצעים קודם כל הדמיה על מנת לראות מיקום רצוי מדויק
- בלתי הפיך
- פגע חשמלי -
- לשתול בעומק המוח אלקטרודה מגרה ודרכה להעביר גרייה גבוה ולחמם את התאים מסביב, מה שגורם לפגע
- חיסרון - לא ממוקד, כל מה שנמצא באזור יהרס.
- פגע אקסיטוטוקסי -
- השתלת צינורית דרכה יוזרק סם לפגיעה באזור ספציפי על ידי גריית יתר, אקסיטציה.
- נהרסים רק גופי התאים
- פגע חשמלי -
- פגע הפיך
- הרדמת אזור
- שינוי יכולת לייצור פ"פ באופן זמני
- פגע סרק - קבוצת ביקורת שעוברת את כל הפרוצדורה חוץ מהפגע

שיטות היסטולוגיות
- מאפשרות להסתכל על רקמה
- חייב להיות מוח ללא תאי דם, מקובע, נקי, פרוס, ולעיתים גם צבוע
פרפוזיה - ניקוי, מעבירים בכלי המוח נוזל שמנקה אותו
קיבוע -- הזרקת חומר שעוצר את כל התהליכים הביולוגיים בו
- המוח נשמר ברמה הביולוגית בדיוק כמו שהיה ברגע ההקרבה
חיתוך -- פריסה של המוח על מנת להתבונן במיקרוסקופ
- בעזרת מכשיר חיתוך לפרוסות מאוד דקות
- את הפרוסה מניחים על זכוכית נושא של מיקרוסקופ
צביעה -- על מנת לראות פריטים בצורה ברורה במוח.
- אפשר ואף שכיח להשתמש בכמה במקביל
- כל צביעה תדגיש אזור/רקמה אחרת
קריאה במיקרוסקופ
נוירואנטומי | ניסל - סימון סומא
- על שם Franz Nissl
- ניסה לטפטף חומרים מעולם הטקסטיל כדיל ראות איך ישפיע על הרקמות
- חומר ניסל - החומר שצבע הכי טוב באופן סלקטיבי אזורים במוח
- בהמשך התגלה שהחומר נקשר לחומצות גרעין, בעיקר לDNA, נקשר לגרעין התא שנמצא בסומא
- משמשת כיום כצביעת בסיס כדי לזהות איפה נמצאים במוח
- לא מאפשר להסתכל על מבנה שלם של נוירון מעבר לגרעין
נוירואנטומי | גולג'י - סימון נוירון שלם
- גולג'י מצא צבע שמלחים של כסף מסמנים באופן אקראי נוירון שלם על כל חלקיו
- היתרון שלא כל הנוירונים נצבעו - אם כולם היו נצבעים היה בלתי אפשרי להבדיל ביניהם
נוירואנטומי | Rainbow - קשרים עצביים סימון כל הנוירון
- מאפשרת באמצאות מניפולציה גנטית להחדיר גן שמייצר חלבון פלורסנטי, פולט אור בגלי אור שונים לנוירונים שונים במוח.
- מאפשר להסתכל על קשרים עצביים בין תאים
- הנוירון נצבע כולו
נוירואנטומי | אמונוציטוכימיה - סימון חלבונים או פפטידים
- שימוש בנוגדנים רדיואקטיביים או בנוגדנים הקשורים למולקולת צבען לשם סימון נוכחותם של חלבונים או פפטידים.
- למשל אנזימים, תעלות, רצפטורים, משאבות, קינזין, מיקרוטובולים וכד'
- חלבונים שומרים על המבנה שלהם גם כשהמוח לא חי יותר, לכן אפשר לצבוע בשיטה זו מוח כשהוא מת
- אנטיגן - חלבון המצוי על גבי חיידק או נגיף
- נוגדן -
- חלבונים המיוצרים בכדוריות הדם הלבנות, מזהים את האנטיגן וגורמים לכדוריות לתקוף אותו.
- פיתחנו שיטות ליצירת נוגדנים לכל פפטיד או חלבון שהוא.
- אופן ביצוע - שמים חתכים טריים של רקמת מח בתמיסה המכילה את המולקולות של הנוגדן שמצורף אליו צבען, הנוגדנים נקשרים לאנטיגנים שלהם (למשל ל - PHA-L) וכך ניתן לראות אילו חלקי מח מכילים את האנטיגן.
- מנצלת את התגובה החיסונית של הגוף -
- לווירוסים יש בממברנה החיצונית חלבוני ספייק, המאפשרים להיכנס לתא כדי על מנת שייצר את הDNA שלו
- מערכת החיסון מכילה תאים הקוראים את חלבוני הספייק, כך שיודעת לא לתקוף חלבונים שלנו, כשמזהים אותם היא מתייגת אותם בעזרת נוגדנים - חלבונים שמיוצרים בתאי מערכת החיסון, ויודעים להתאים את הנוגדן לרצף חומצות אמינו ייחודי. כלומר לכל אנטיגן יש יכולת לגרום למערכת החיסון לייצר נוגדן ספציפי אליו
- ברגע שהפתוגן מסומן על ידי נוגדנים מגיע תא נוסף של מערכת החיסון, תפקידו לחסל כל תא שסומן בנוגדן. לוקח בין שעות לימים.
- בצביעה מתבססים על יכולת זו של יצירת חלבון ספציפי עבור חלבון אחר, על מנת להצליח לצבוע חלבונים בצבעים שונים ולהצליח לזהות אותם באופן מאוד מדויק
נוירואנטומי | סימון קדמוני - התחקות אחר אקסונים מוציאים
- התחקות אחרי קשרים עצביים ואזורי פלט סינפטיים
- התחקות אחר אקסונים מוציאים - Efferent neurons
- במוח חי בלבד (בהרדמה)
- על ידי חלבון PHA-L
- מופק משעועית
- סימון קדימה בלבד
- מזריקים לחיה ערה PHA-L
- מחכים מספר ימים כדי שהוא יגיע לכפתורים הסופיים על ידי הולכה אקסופלזמטית קדומנית
- מרדימים את החיה ומבצעים את הנהלים ההיסטולוגיים
- גורמים לחלבון ה- PHA-L להראות על פני הזכוכית המקרוסקופית באמצעות אימונוציטוכימיה.
- נוכל לדעת איפה הפלט של המקום אליו הזרקנו
נוירואנטומי | סימון אחורני - התחקות אחר אקסונים מביאים
- בדומה לסימון קדמוני, אך במטרה למצוא את אזורי הקלט
- התחקות אחר אקסונים מביאים neurons Afferent
- על ידי סמן שיודע בדר"כ לנצל תהליכים של Reuptake ואנדוציטוזה
- הסמן נכנס לנוירון הפרה-סינפטי ומתפזר אל הסומא
- לדוגמא פלואורוגולד - בעל תכונות פלורסנטיות ולכן קל לאתר אותו
- חיסרון - מאפשר לסמן סינפסה אחת בלבד
נוירואנטומי | סימון טראנס-נוירוני - קשרים סינפטיים
- מאפשר לסמן רצף סינפסות
- נפוץ בשימוש בווירוסים
- אופן ביצוע:
- מזריקים את וירוס ליעד מסוים
- מחכים שהוא ידביק נוירונים בשרשרת
- ממיתים את בעל החיים ומזהים בעזרת אימונוציטוכימיה את החלבון אותו מייצר הוירוס שהוזרק
- סוגים שונים של וירוסים מסמנים בכיוון שונה, למשל הרפס קדימה, פסאודו-ראביס אחורה וכד'
- חסרונות:
- הנוירונים ההתחלתיים עלולים להיפגע ואף למות לכן חשוב לקחת בחשבון כמה זמן מחכים מרגע ההזרקה
- גורם לפגיעה ברקמת המוח באופן כללי
- הווירוס יכול להתקדם יותר מידי ובאופן מבולגן אם נמתין זמן ממושך מידי
מחקר תפקודי
המטרה
לקשור בין תפקוד אזור מסוים להתנהגות
איך נחקור?
לקשור בין תפקוד אזור מסוים להתנהגות
איך נחקור?
- נגרה באופן זום ונראה כיצד השפיע על ההתנהגות
- נתבונן בהתנהגות ובמהלכה נבצע רישום הפעילות המוחית
תפקודי | מיקרו-אלקטרודות - רישום פעילות חשמלית אזורית
- רישום פעילות חשמלית של נוירונים
- שותלים את האלקטרודה על ידי ניתוח סטריאוטקטי
- האלקטרודה רושמת, אינה מגרה
- בזמן ביצוע משימה נמדוד את הפעילות החשמלית של אותו האזור בו שתלנו
- חיסרון -
- אינה מאפשרת להיכנס לתא ספציפי, אינה מספיק קטנה. אם נרצה לבודד נוכל מאחר מכן להסתכל בתוך צלוחית מעבדה.
- לא מאפשר לחקור את כל ההתנהגויות כי האלקטרודה מגבילה אותה פיזית מהתנהגויות מסוימות. הפתרון לכך שנוירון שעובר בתדר גבוה ניצל הרבה אנרגיה, ויצטרך לייצר מחדש ATP. נוכל לראות בתוך המוח אילו נוירונים צרכו יותר גלוקוז וחמצן
תפקודי | רישום יחידה אחת - רישום פעילות חשמלית נוירון יחיד
- רישום פעילות חשמלית
- שתילת אלקטרודה בתוך נוירון בודד או חלקיו
- חיסרון - רק בצלוחית מעבדה, לא בתוך אורגניזם חי
תפקודי | 2DG - רישום פעילות מטאבולית
- נזריק לחיות לפני ההתנהגות 2DG (חומר דמוי גלוקוז) ונסמן אותו בסימון רדיואקטיבי שיאפשר לזהות בהמשך את מיקומו במוח
- בשונה מגלוקוז 2DG לא מתפרק ורק מצטבר בתוך התא
- מזהים בעזרת אוטורדיוגרפיה
תפקודי | אוטורדיוגרפיה - רישום קרינה עצמית
- רישום קרינה עצמית
- משתמשים על מנת לאתר קרינה רדיואקטיבית, לדוגמא את ה2DG שהוזרק
- על ידי חומר רגיש לקרינה נצפה את זכוכית הנושא עם חתך המוח עליו, ונצפה במיקרוסקופ
- חשיפה לחומרים רדיואקטיבית
- הרזולוציה המרחבית לא מספיק טובה, קשה לזהות תאים ספציפיים
תפקודי | חלבון FOS - רישום פעילות סינפטית
- רישום פעילות סינפטית
- נוירונים פעילים עוברים בלאי, יש צורך לחדש את מלאי החלבונים. לשם כך מועלים בגרעין גני על שמייצרים חלבונים המפעילים גנים אחרים ומזרזים את תהליך השיעתוק שלהם.
- חלבונים ניתן לזהות לאחר מכן עם אימונוציטוכימיה, על ידי נוגדן מתאים לחלבון FOS
סקירה
יתרונות -
- אין צורך להזריק לאורגניזם חומרים
- לא חושף לחומרים מסכנים
- אין צורך בתהליך קדם
- אין מגבלות פיזיות להתנהגות
תפקודי | גרייה עצבית
- חשמלית -
- שתילת אלקטרודה בניתוח סטריאוטקטי
- נעביר גירוי חשמלי חלש יחסית על מנת לא להרוס את הרקמה
- כימית -
- שתילת קנולה דקיקה בניתוח סטריאוטקטי ודרכה להזליף חומר מעורר
- כמו חומצה אמינית מעוררת כמו גלוטמט
- נזריק במינון נמוך יחסית על מנת למנוע הרס של התא
- נוכל לבחור חומר ספציפי כדי לבצע גרייה סלקטיבית
- חיסרון -
- הגרייה אינה ספציפית מספיק, החומר/המתח מתפזר ונפעיל יותר תאים ממה שרצינו
- האלקטרודה מפריעה פיזית להתנהגות
- יתרון - תגובה מהירה לשני סוגי הגרייה
תפקודי | אופטוגנטיקה optogenetic methods - רישום ושליטה נוירון בודד
מטרה
- לצפות ולשלוט ברמת הנוירון הבודד
- אפשר ללמוד באמצעותם על תפקודם של מעגלים עצביים מסוימים במוח
- גירוי או עיכוב של נוירונים מסוג מסוים על־ידי הפעלת חלבונים רגישי־אור השולטים על פתיחת תעלות יונים.
- על ידי תעלות יונים רגישות לאור -
- תעלת נתרן ChR2 -
- רגישה לאור כחול
- גורמת דה-פולריזציה
- תעלת כלור NpHR -
- רגישה לאור צהוב
- גירוי מעכב
- תעלת נתרן ChR2 -
- מייצרים תא גנטי הכולל:
- החומר הגנטי - הוראות ליצירת אחת מהתעלות
- פרומוטור
- קובע מתי ואיפה הרצף הגנטי יתבטא
- נבחר את הפרומוטור בהתאם לרקמה/נוירון אליה נרצה להזריק את הווירוס
- נזריק את שניהם לתוך וירוס - הוירוס יודע להזריק את החומר הגנטי לתא מאחסן
- את הווירוס נזריק לחיה הנחקרת
- בתאים המתאימים הגן יתבטא ובממברנות ייצרו את התעלות אותן רצינו ליצור.
- נפעיל את התעלות על ידי האור המתאים בעזרת השתלת והפעלת סיב אופטי
- יתרונות -
- ספציפיות גבוהה בהפעלת הנוירונים המופעלים
- רזולוציית הזמן - הנוירונים פועלים/מפסיקים לפעול ברגע שמדליקים/מכבים את האור
- חסרונות -
- מורכב ודורש תכנון מאוד מדויק, עם ידע מקדים נרחב על מנת לייצר את החלבון הנכון
- החיה מסתובבת עם סיב אופטי כי חייב להגיע לעומק המוח, ונוצרת מגבלה פיזית להתנהגות.
- מחקר התנהגותי
- חוקרים השתמשו בשיטות אופטוגנטיות כדי להכניס תעלות יונים תלויות ChR2 לתוך הממברנות של נוירונים דופמינרגיים באזור הטגמנטום הגחוני של חולדות.
- מצאו שאם עוררו את הנוירונים האלה בשעה שהחולדות שהו באחד משני תאים בכלוב מיוחד שבו נבדקה התנהגותם, החיות העדיפו לבלות יותר זמן בתא שבו קיבלו את העירור מכיוון שהתאים האלה מעורבים בתגמול.
- מחקר קליני
- מחלה גנטית בשם retinitis pigmentosa גורמת עיוורון לבני אדם.
- בני אדם הסובלים ממחלה זו נולדים עם ראייה תקינה אך מתעוורים בהדרגה כי קולטני האור ברשתיות שלהם מתנוונים.
- הקנים של אנשים הסובלים מהמחלה מתים וגם המדוכים מאבדים את הרגישות לאור, אבל גופי התאים שלהם שורדים.
- חוקרים השתמשו בשיטה אופטוגנטית כדי לנסות לשקם את ראייתם של עכברים המפתחים את המחלה עקב מוטציה גנטית שנגרמה להם.
- חלבוני NpHR הוחדרו לתוך המדוכים.
- בדקו רישומים חשמליים ואת התנהגות העכברים
- מצאו שהטיפול שיקם את ראייתם לפחות באופן חלקי.
- הטיפול שיקם את הרגישות לאור ברקמה מרשתית שהוסרה לאחר מותם של בני אדם שסבלו מהמחלה.
נוירוכימי | סימון נוירונים שמייצרים נ"ט מסוים
- על ידי אימונוציטוכימיה לסימון אנזימים המעורבים ביצירת הנ"ט
- למשל -
- סרוטונין - נוגדן לטריפטופאן אקסוטילאז
- נוראפניפרין - נוגדן לדופמין בטא הידרוקסילאז
- נוירונים דופמינרגיים - נוגדן אחד לטירוזין הידרוקסילאז, יסמן גם דופמינרגיים וגם נוראדרנרגיים. נוגדן נוסף דופמין בטא הידרוקסילאז, וכך נזהה את אלה שלא סומנו
- אם מעורבים מספר אנזימים חשוב לסמן את האחרון בלבד
נוירוכימי | סימון מיקום רצפטורים מסוימים
- רצפטור הוא סוג של חלבון לכן ניתן להשתמש באימונוציטוכימיה
- ליגנד רדיואקטיבי -
- מסמנים את הליגנד בסמן רדיואקטיבי
- מטפטפים על התא
- מזהים מיקום וכמות על ידי אוטורדיוגרפיה
נוירוכימי | מיקרודיאליזה - כמות נ"ט וחומרים בנוזל תאי
- מדידת כמות נ"ט במוח החי
- בדיקה של חומרים המצויים בנוזל הבין תאי
- למשל אנזימים, טרנסמיטרים יונים וכדומה
איך מבוצעת?
- נשתול על ידי ניתוח סטראוטקטי את צינורית המיקרודיאליזה, בעלת שתי צינוריות: כניסה ויציאה - אל מבחנה
- את נוזל המוח מהמבחנה נשים במכשיר HPLC, המאפשר לעשות הפרדת פאזות לפי חומרים שונים - נקבל במחשב גרף המתאר את כמות כל חומר בנפרד ברגע נתון על ציר הזמן.
מחקר גנטי
- בעכברים מאפשרות לבצע מניפולציות על מנת להגביר/לשתק פעילות/טרנסקריפציה של גן ספציפי, חלבון אחד ספציפי
- עבר Knockout - שאיבד גן מסוים
- עבר טרנסגני - שנוסף לו גן מסוים
- איך מבצעים?
- פורסים את הDNA
- מזהים את הגן רצוי
- הוצאת/הריסת גן - מכניסים אותיות "ג'יבריש" על מנת לפגוע בגן, בלתי הפיך.
- הוספת גן - חיתוך והוספה של הגן, לעיתים גם כזה שכבר יש לו על מנת שייצר יותר, בלתי הפיך.
- פגיעה בגן מסוים -
- נוקאאוט ללא פגיעה בDNA על ידי עיכוב התירגום, פגיעה בRNA.
- על ידי אוליגונוקלאוטידים משלימים, נוקלאוטידים מלאכותיים המתחברים לmRNA וגורם לכך שהריבוזום לא יוכל לתרגם אותו.
- יתרון - האוליגונוקלאוטיד מתפרק, כמו גם הmRNA, וניתן לייצר מחדש mRNA תקין, כלומר המניפולציה הפיכה.
- שיטה יחסית פשוטה לעבודה
מחקר נוירוכימי
איכון נוירוכימיקלים
סימון כפול
- זיהוי מקום הכימיקל עצמו
- על מנת לגלות את אתר הפעולה של סמים מסוימים במוח אנו צריכים לדעת מהיכן מופרש הטרנסמיטר עליו הם פועלים.
סימון כפול
- ניתן להשתמש בשתי שיטות סימון על רקמה מוחית אחת
- על מנת לקבל תמונה מלאה יותר.
- ייתן מענה לשתי שאלות מחקר שונות.
- למשל ניתן לזהות את מקום הייצור של נוירוטרנסמיטור על ידי סימון ה אנזים המייצר, ואת מסלול האקסונים היוצאים ממקום זה בעזרת שיטת סימון קדמוני. כך נוכל לדעת שדופאמין מיוצר בחומר השחור ובטגמנטום הגחוני, ושהוא נשלח דרך שלוש מערכות אקסונים לחלקי המוח השונים.
אנטונמי | טומוגרפיה ממוחשבת CT
- במוח החי
- מבוסס סדרת סריקות/צילומי רנטגן
- מעבירים קרינת X דרך הראש של הנבדק
- הקרן נבלעת בתאים כתלות במידת צפיפות הרקמה
- צפופים בלבן
- פחות צפופים בשחור
- הקרן עוברת דרך הראש עד שיוצאת מהצד השני בו יש חיישן שיודע למדוד את מידת הבליעה של הקרן בנקודות זמן שונות לאורך העברתה.
- הפלט המקורי הוא מספרים המייצגים את תוצאות החיישן, בהמשך פותח אלגוריתם שהופך את המספרים לתמונה.
- חסרונות:
- הקרינה מסוכנת - פוגעים בתאים ולכן נעדיף להיחשף פחות
- חומר ניגוד - כדי להגביר את הניגודיות מזריקים חומר ניגוד , בדר"כ מבוסס יוד, אנשים רבים אלרגיים אליו עד כדי סכנת חיים.
- רזולוציה מרחבית - לא טובה כל כך, מספיק לזיהוי גידולים אך מידע רב נוסף לא נחשף
- לא נותן אינדיקציה על תפקוד/פעילות המוח, רק תמונה אנטומית
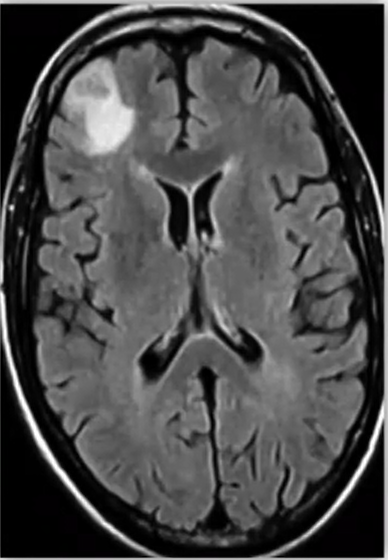
אנטומי | הדמיית תהודה מגנטית MRI
- במוח החי
- מבוסס על כך שבראש יש לנו מולקולות בעלות קוטב/פולריות חשמלית
- בשדה לא מגנטי - המולקולות מסודרות באופן אקראי
- בשדה מגנטי - כל המולקולות יתיישרו לאותו הכיוון.
- עובר בראש גל רדיו, פוגע במולקולות המים ומסובב אותן
- ניתן לראות את צפיפות המים ולפיך את צפיפות הרקמה -
- צפופים - פחות מים, לבן
- פחות צפופים- יותר מים, שחור
- רזולוציה גבוהה מאוד
- חסרונות -
- יקר יותר משמעותית מCT - המגנט, המכשיר עצמו, זמינות נמוכה, הכשרת הצוות וכד'
- לא נותן אינדיקציה על תפקוד/פעילות המוח, רק תמונה אנטומית
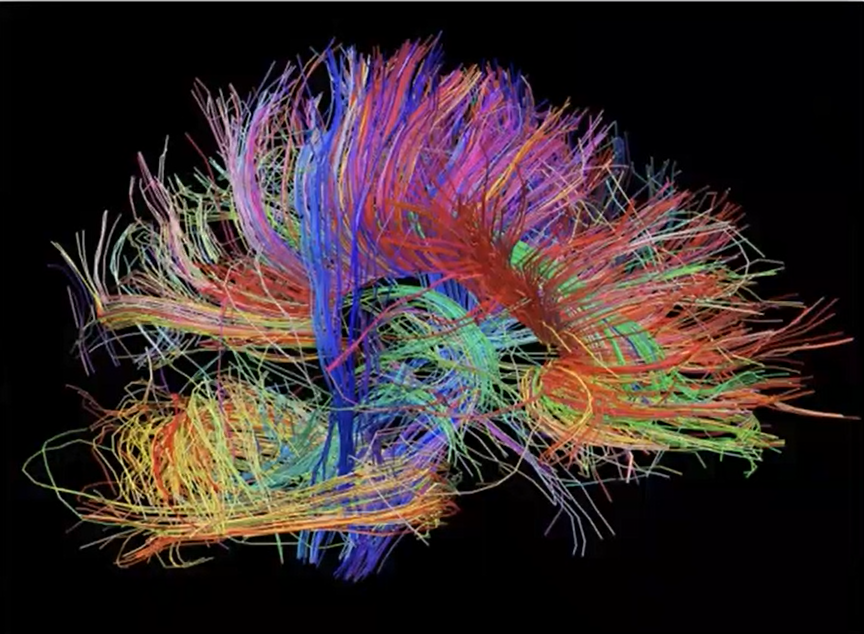
אנטומי | שיטת DTI
- מעקב אחר התקדמות של מולקולות מים במרחב המוחי
- נקבל תמונת סיב אקסונים המתקדם מנקודה לנקודה
- מאפשרת למפות את טיב הקשרים העצביים במוח
- מאפשר לייצר דיאגרמת חיווט בבני אדם
- לא נותן אינדיקציה על תפקוד/פעילות המוח, רק תמונה אנטומית
תפקודי | טומוגרפיה של פליטת פוזיטרונים PET
- באדם חי
- מזריקים לאדם חומר רדיואקטיבי
- הראש מקובע
- מכניסים למכשיר הPET - מבוסס על עקרונות הCT - עוברת קרינת X
- החומר הרדיואקטיבי נקלט על ידי החיישן של הPET
- האזורים במוח בהם כרגע נדרשת רמה גבוהה של סוכר, בהם תיפלט יותר קרינה רדיואקטיבית, עקרון דומה ל2DG
- ממפה את מיקום החומר הרדיואקטיבי שנמצא ברגע נתון באזורים שונים במוח -
- פעילים יותר - צבע אדום וחם יותר
- פעילים פחות - פחות אדום וצבעים קרים
- חסרונות -
- חשיפה לקרינה
- חשיפה לחומר רדיואקטיבי
- הכנת החומר הרדיואקטיבי מורכבת ויקרה
- רזולוציה מרחבית נמוכה
- רזולוציה טמפורלית נמוכה - לוקח זמן עד שהנוירון קולט את הגלוקוז, והתמונה אינה מהירה מספיק עבור פעולות מהירות.
- כיום משתמש בעיקר ל-2 צרכים -
- איתור אזורים פעילים מטבולית, בעיקר לגידולים
- ניתן למדוד בדרכים עקיפות שיטות נוירוכימיות על ידי PET
תפקודי | מגנטו-אנצפלוגרפיה MEG
- כשזרם חשמלי עובר דרך מוליך, הוא משרה שדה מגנטי.
- פוטנציאלי פעולה העוברים באקסונים או פוטנציאלים פוסט סינפטיים העוברים בדנדריטים או לאורך ממברנת גוף התא של הנוירון, יוצרים שדות מגנטיים.
- SQUID - גלאי מוליך-על לזיהוי שדות מגנטיים זעירים
- נוירומגנטומטרים -
- מכשירים הכוללים מערכת של גלאי SQUID
- מחשב בוחן את הפלט שלהם ומאתר מאין מגיעים אותות מסוימים במוח.
- שימושים:
- מטרות קליניות - מקורם של התקפים כדי להסירו בניתוח.
- מטרות מחקריות - מדידת פעילות מוחית אזורית המתרחשת עם תפיסת מגוון גירויים או עם ביצוע של מגוון התנהגויות או של מטלות קוגניטיביות.
- יתרון - מהירות
- חיסרון - רזולוציה מרחבית נמוכה יותר
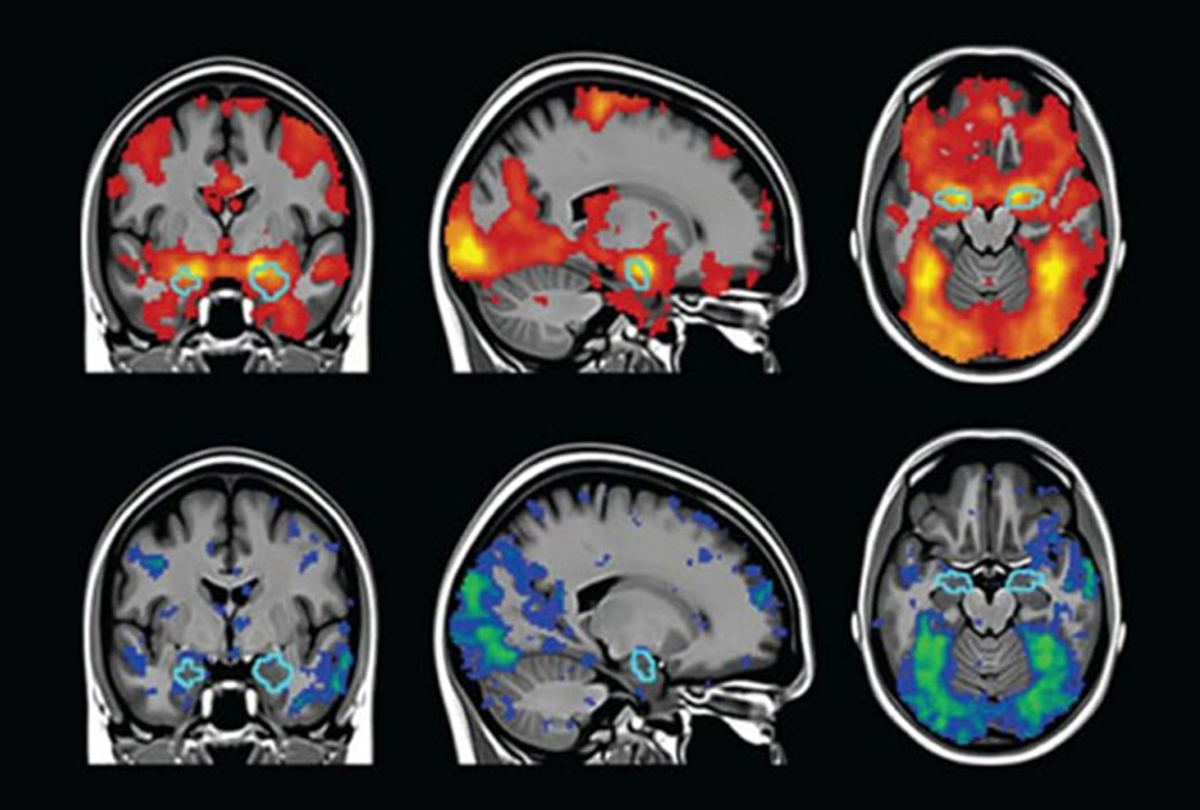
תפקודי | הדמיית תהודה מגנטית תפקודית fMRI
- מודד את כל מה שMRI מודד
- בנוסף לכך מודד את צפיפות ההמוגלובין המחומצן, אשר נושא את החמצן לתא, ביחס להמוגלובין המחוזר, ללא החמצן.
- היחס בין שני מצבי ההמוגלובין נותן מדד עקיף ביחס לכמה חמצן אזור מוחי קלט כחלק מהפעילות המטבולית שלו.
- יתרון - רזולוציה מרחבית טובה יותר מPET
- חיסרון -
- רזולוציה טמפורלית טובה יותר מPET אך עדין לא טובה מספיק
- יקר
תפקודי | אלקטרואנצפלוגרום EEG
- מודד שדות חשמליים המבוססים על אותות נוירונים שפעילים בסמוך לאלקטרודה המונחת על הראש מבחוץ
- נניח הרבה מאקרו אלקטרודות (גדולות) עם ג'ל שמחדד את המוליכות החשמלית
- חסרונות -
- רזולוציה מרחבית נמוכה, הפעילות הנקלטת היא הסה"כ של הנוירונים באזור, ולא של נוירון ספציפי
- מודד מצוין פעילות קורטיקלית, אך לא פעילות בעומק המוח
- יתרונות -
- זול יחסית
- אינדיקציה טובה לפעילות קורטיקלית משמעותית - ככל שהמכשיר רגיש יותר, מכיל יותר אלקטרודות המאפשרות מיפוי טוב יותר מרחבית, ובזכות הרגישות הטמפורלית שלו שינויים
- האדם יכול לזוז - לבצע פעולות מורכבות יותר משאר הבדיקות
- יישומים מרכזיים -
- איתור מוקד אפילפטי
- הערכת שינה
תפקודי | גירוי בזמן ניתוח
- גירוי מוח ובדיקת ההשפעה על ההתנהגות
- שתילת אלקטרודה במהלך ניתוח, ובדיקה כיצד משפיע על ההתנהגות
- משמש להעריך סיכון בהוצאה של חלק מסוים במוח
תפקודי | גרייה מגנטית חוצת גולגולת TMS
- גירוי מוח ובדיקת ההשפעה על ההתנהגות
- מכשיר בתוכו זורם זרם היוצר שדה מגנטי, ומשפיע על הפעילות החשמלית של הנוירונים
- לרוב מעכבים, יכול גם לעורר
- מעביר גרייה חשמלית ממוקדת
- הגרייה יכולה להגיע לעומק המוח ולא רק לקורטקס
- יתרון -
- לא פולשנית
- אין תופעות לוואי
- שימוש עיקרי -
- טיפול קליני לדיכאון

תפקודי | גרייה קבועה בעומק המוח
- גירוי מוח ובדיקת ההשפעה על ההתנהגות
- שתילת אלקטרודה בעומק המוח ומשאירים אותה שם
- האלקטרודה מעבירה גרייה חשמלית באופן קבוע
גנטי | מחקרי משפחה
- מעקב אחרי שכיחות התנהגות/פתולוגיה
- בתוך חברה בעלת קשרים גנטיים
- מטרתה לבדוק האם יש קשר בין הקרבה לשכיחות הפתולוגיה
- משמשת לבדוק כתלות בגן מה הסיכון של הצאצאים להיות חולים גם כן
- גן יחיד דומיננטי -
- בטוח יבוא לידי ביטוי
- 50% מהצאצאים יהיו בעלי המחלה
- שילוב גנים -
- מספר גנים מעורבים
- הסביבה משפיעה על ביטוי הגן
- משווים אוכלוסיות לפי מידת הקרבה הגנטית, הכי טוב תאומים זהים ביחד לתאומי אחווה, כאשר בכל זוג אחד בטוח חולה במחלה, ובודקים מה ההבדלים ביניהם במידת הסיכון למחלה מסוימת, באיזו שכיחות שני התאומים יהיו זהים, בהנחה שמידת הדמיון הסביבתי דומה.
- גן יחיד דומיננטי -
מחקרי תאומים -
- משמשים להשוואת תוצאות סביבה לתורשה
- זהים -
- הקרובים ביותר גנטית
- חולקים כמעט 100% מהשונות הגנטית
- ההבדלים היחידים הם השינויים הגנטיים לאחר שנפרדו
- תאומי אחווה -
- חולקים בממצע 80% מהשונות הגנטית
מחקרי אימוץ -
- משמש להשוואת תוצאות סביבה לתורשה
- נחפש אנשים עם הפרעה מסוימת, אומצו בגיל צעיר ככל האפשר
- נפנה אל בני המשפחה, ונסתכל בקבוצה אחת על הקבוצה ביולוגית, ובשנייה על המשפחה המאמצת -
- אם למחלה רגע גנטי חזק יותר מסביבתי - נמצא יותר פריטים חולים במשפחה הביולוגית, ובמשפחה המאמצת אומרה להיות כמו השכיחות הכללית באוכלוסייה
- אם למחלה רגע סיבתי ולא גנטי - נצפה לראות יותר פריטים חולים במשפחה המאמצת ובמשפחה הביולוגית פחות
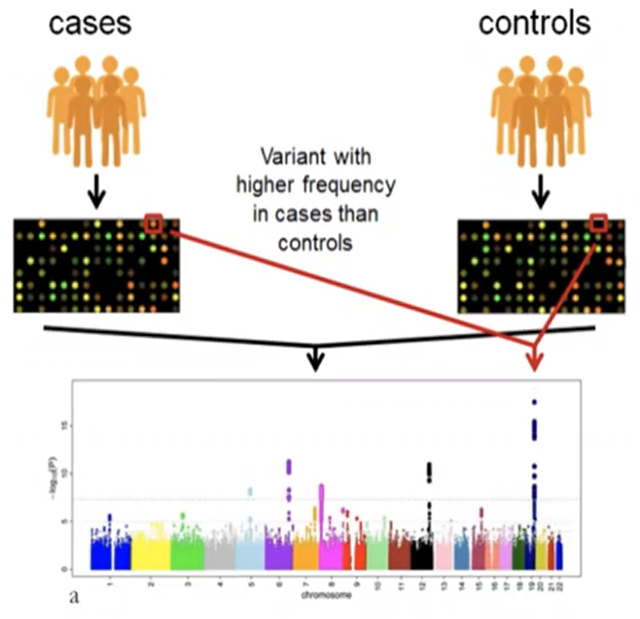
גנטי | מחקרי גנום
- לוקחים את כל הגנום, כל רצף הDNA שיש לאדם
- בודקים לפי הרצפים השונים בגנום המלא, האם יש רצפים דומים לאוכלוסיית החולה, ביחס לאוכלוסיית הביקורת שאינם חולים.
- אזורים המופיעים יותר אצל החולים לעומת הבריאים - נראה מובהקות סטטיסטית גבוהה יותר
- במידה ומזוהים רצפים/אות ספציפיים, ניתן לחקור לעומק את הגן
- ניתן לגלות כך את המנגנונים עליהם אחראים שילוב הגנים ואת הקשר שלהם למחלה מסוימת
- מבוצע על ידי PCR